La historia del desarrollo de los medicamentos abarca desde los remedios empíricos de la antigüedad hasta las terapias moleculares de hoy. A continuación se presenta un recorrido cronológico por épocas, destacando fechas clave, descubrimientos científicos fundamentales en química, biología y biotecnología, el papel de la industria farmacéutica en cada etapa, así como los errores y tragedias que impulsaron mejoras en el conocimiento y la regulación.
Circa 2700-2500 a.C.: En China, la tradición atribuye al emperador mítico Shennong la compilación de un herbario medicinal. El texto Shennong Bencao Jing (Pen Ts’ao) recopiló cientos de plantas y sus usos terapéuticos, marcando uno de los primeros registros farmacológicos de la historia.
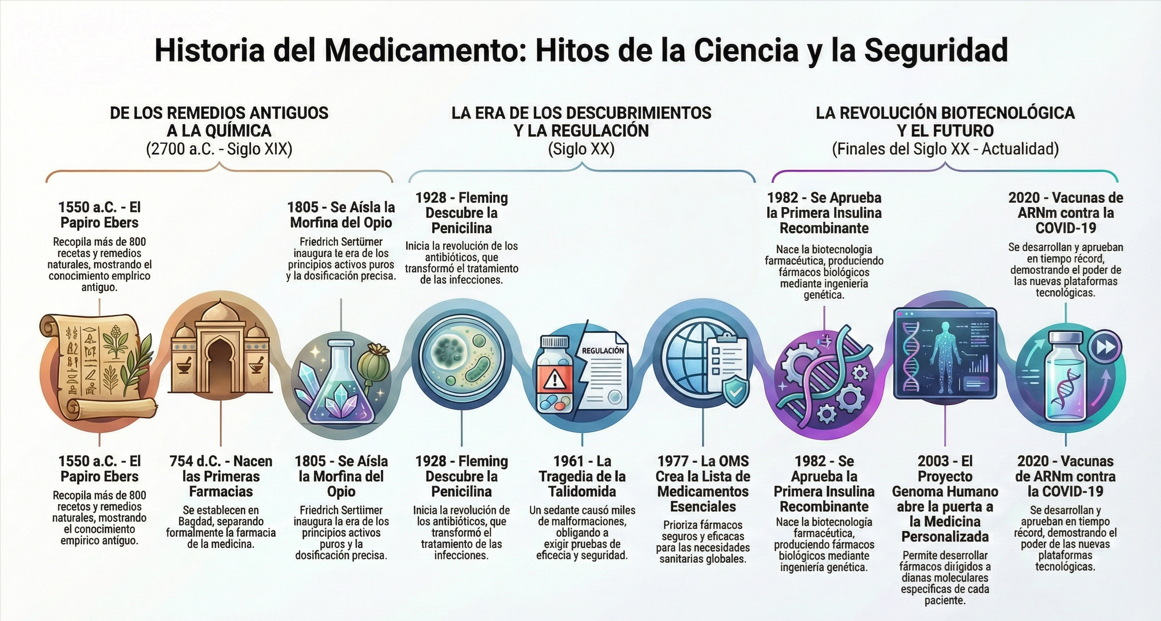
1550 a.C.: En el Antiguo Egipto, se redacta el Papiro Ebers, un extenso tratado médico con unas 800 recetas y remedios a base de plantas y otros productos naturales. Este papiro describe el tratamiento de dolencias comunes con ingredientes como ajo, aloe, enebro y corteza de sauce. (De hecho, la corteza de sauce —rica en salicina— era utilizada para aliviar dolores, siendo precursora del principio activo de la aspirina). Estas fuentes reflejan que las civilizaciones antiguas desarrollaron un conocimiento empírico extenso sobre plantas medicinales y remedios.
Siglos V-IV a.C.: En la Antigua Grecia, se afianzan los fundamentos de la medicina racional. Hipócrates de Cos (c. 460 a.C.) rechaza las explicaciones mágicas de la enfermedad e impulsa una medicina basada en la observación; se le atribuye, por ejemplo, recomendar la corteza de sauce como analgésico natural para fiebres y dolores articulares. Diócles de Caristo y Teofrasto (s. IV-III a.C.) clasifican sistemáticamente plantas medicinales, sentando las bases de la botánica farmacéutica.
Siglo I d.C.: El médico griego Dioscórides escribe De materia medica (c. 60 d.C.), un compendio de cinco volúmenes que describe más de 600 plantas y sus preparaciones terapéuticas. Esta obra se convirtió en referencia fundamental de farmacología durante más de 15 siglos, transmitiendo conocimientos desde la antigüedad grecorromana hasta el Renacimiento. En la misma época, el romano Galen (s. II d.C.) desarrolla formulaciones de medicamentos combinando múltiples ingredientes (galénicos), por lo que es considerado el padre de la farmacia por sus aportes a la preparación de fármacos. La tradición galénica dominó la farmacoterapia durante siglos.
754 d.C.: En la capital del califato abasí (Bagdad) se establecen las primeras boticas o farmacias abiertas al público. La civilización islámica no solo preservó los textos médicos grecorromanos (traduciendo a árabe a Galeno, Dioscórides, etc.), sino que amplió el conocimiento farmacológico con fuentes persas, indias y árabes. Para el siglo IX estas farmacias de Bagdad ya eran reguladas por el Estado, marcando la separación de la profesión farmacéutica respecto de la medicina.
c. 850-900 d.C.: Aparecen los primeros libros de farmacopea en el mundo islámico. El persa Shapur ibn Sahl (m. 869) redacta uno de los primeros formularios farmacéuticos, describiendo una gran variedad de medicamentos y remedios. A su vez, médicos como Al-Razi (Rhazes) en Persia (865–925) promueven el uso terapéutico de sustancias químicas, y Al-Zahrawi en Al-Ándalus (936–1013) perfecciona técnicas de destilación y sublimación para preparar fármacos. La invención del alambique y el alcohol destilado permitió obtener extractos más puros, una innovación clave de la química árabe.
980–1037: Avicena (Ibn Sina), médico persa, escribe el Canon de la Medicina, enciclopedia médica que incluye un volumen entero dedicado a sustancias medicinales. Avicena describió unas 700 preparaciones con sus propiedades y usos, e introdujo formas farmacéuticas variadas (jarabes, tabletas, ungüentos, etc.). Por sus aportes, es considerado padre de la farmacología y promotor de la separación definitiva entre medicina y farmacia en Oriente Medio.
Siglos XII-XIII: En plena era medieval, eruditos como Ibn al-Baytar (m. 1248) compilaban grandes herbarios con cientos de drogas de origen vegetal, animal y mineral. Las obras farmacéuticas árabes de esta época llegaron a listar más de 1400 sustancias medicinales distintas. El conocimiento árabe se transmitió a Europa a través de traducciones latinas desde el siglo XI, sentando una base para el renacer científico occidental.
1498: Surge la primera farmacopea oficial en Europa. En Florencia (Italia) se publica el Nuovo Receptario, un libro colaborativo respaldado por el gremio de boticarios y la facultad de medicina, que fue adoptado como estándar legal para la preparación de medicamentos. Esta obra marcó el inicio de la regulación farmacéutica estatal en Europa, asegurando la calidad y uniformidad de los remedios. (En España, poco después, se publicaron antídotarios y concordias similares, como las Concordias de Barcelona en 1511).
Siglo XVI: Paracelso (Philippus Aureolus Theophrastus, 1493–1541) revoluciona la terapéutica al introducir sustancias químicas como medicamentos, rompiendo con la tradición galénica. Defiende que “la dosis hace el veneno” y utiliza compuestos minerales como mercurio o antimonio para tratar enfermedades. Paracelso diseñó así los primeros fármacos basados en la química, sentando las bases de la bioquímica médica y de la toxicología moderna. Sus ideas iniciaron la llamada yatroquímica, orientando la medicina hacia explicaciones químicas del cuerpo y la enfermedad.
Avances científicos generales: El Renacimiento propicia una recuperación crítica del saber clásico y la observación directa de la naturaleza. En 1543, Vesalio revoluciona la anatomía humana con su obra De humani corporis fabrica, mientras Ambroise Paré innova en cirugía. Estos progresos en anatomía y fisiología sientan un terreno fértil para el uso racional de medicamentos. Se inventan nuevas formas farmacéuticas en este periodo, como los extractos sólidos, elixires y tinturas alcohólica, gracias a mejoras en técnicas de extracción. No obstante, también proliferan remedios secretos y el uso supersticioso de drogas, lo que eventualmente impulsará demandas de regulación y eficacia comprobada.
Siglo XVII: La ciencia moderna despega con el método experimental de Galileo, Bacon y Descartes. En terapéutica, la yatroquímica sigue en auge durante el 1600, buscando explicar las funciones corporales en términos químicos. Se publican farmacopeas nacionales en varios países europeos, institucionalizando el conocimiento farmacéutico. Por ejemplo, en 1617 se funda en Londres la Worshipful Society of Apothecaries, primera corporación profesional de boticarios en el mundo anglosajón, separando formalmente a los boticarios del gremio de los tenderos.
Descubrimientos químicos: La farmacia y la química se entrelazan fuertemente. Farmacéuticos-químicos como Carl Wilhelm Scheele (1742–1786) realizan experimentos fundamentales desde sus laboratorios en boticas. Scheele descubrió elementos y compuestos claves –oxígeno, cloro, glicerina, ácido tartárico, entre otros– trabajando en la rebotica. También Antoine Lavoisier (1743–1794) establece la ley de conservación de la masa y la química moderna a finales del siglo XVIII, aportando conceptos de estequiometría vitales para formular medicamentos con dosis precisas.
1796: El médico inglés Edward Jenner lleva a cabo la primera vacunación exitosa de la historia contra la viruela. El 14 de mayo de 1796 inocula a un niño con material de viruela bovina (cowpox), logrando protegerlo de la viruela humana. Este hito marca el nacimiento de la inmunología preventiva y de la vacuna (término derivado de vaca), cambiando para siempre el desarrollo de medicamentos biológicos. A raíz de ello, la vacunación se difunde en Europa (expedición Balmis en 1803 en España y América) y sienta las bases de la medicina preventiva moderna.
Farmacia e industria naciente: Hacia finales del siglo XVIII, la elaboración de medicamentos comienza a trascender el ámbito artesanal. La Revolución Industrial introduce maquinaria y mejoras en la producción: por ejemplo, se desarrollan métodos para extraer principios activos de plantas en mayor pureza. Surgen también las primeras instituciones científicas y educativas (academias, colegios de farmacia) que profesionalizan la formación del farmacéutico. Todo ello prepara el terreno para los grandes avances del siglo XIX.
1805: El farmacéutico alemán Friedrich Sertürner aísla por primera vez un principio activo puro de una planta medicinal: la morfina, obtenida del opio. Este logro inaugura la era de la alcaloquimia y demuestra que los efectos de las plantas se deben a compuestos químicos específicos. En décadas siguientes se aíslan otras sustancias clave de origen natural, como la quinina de la corteza de cinchona (Pierre Pelletier y Joseph Caventou, 1820), la cafeína (F. Runge, 1820), la atropina (Mein, 1833) o la digoxina de la dedalera. Estos avances permitieron por primera vez dosificar con precisión los fármacos y comprender mejor su mecanismo de acción.
1850-1880: El auge de la química orgánica impulsa la síntesis de medicamentos. Químicos como Charles Gerhardt y Hermann Kolbe sintetizan el ácido salicílico (precursor de la aspirina) en 1853-1859, haciendo posible fabricar en laboratorio moléculas que antes solo se obtenían de plantas (como el sauce). En 1856, William Perkin descubre el primer tinte artificial (malva), catalizando la industria química; muchas compañías de colorantes (en Alemania, Suiza) se diversificaron luego en la producción de fármacos. Para finales del siglo XIX, empresas que luego serían gigantes farmacéuticos –p.ej. Merck (Alemania), Bayer (Aspirina, 1899), Eli Lilly, Schering, Roche– ya estaban produciendo medicamentos a escala industrial, sentando las bases de la industria farmacéutica moderna.
Germenes y vacunas: Los avances en microbiología transforman la medicina en este siglo. Louis Pasteur propone la teoría germinal de las enfermedades (1861) y desarrolla vacunas atenuadas contra el ántrax (1881) y la rabia (1885). Robert Koch descubre los bacilos de la tuberculosis (1882) y el cólera (1884), y sus postulados fundamentan la etiología infecciosa. Estas conquistas científicas permiten diseñar intervenciones biológicas: se producen sueros antidiftéricos (Emil von Behring, 1890, premiado con el primer Nobel de Medicina en 1901) y se consolida el concepto de inmunización activa y pasiva como parte del arsenal terapéutico.
Rol de las farmacias: Durante el siglo XIX las farmacias de comunidad se multiplican y profesionalizan. Los boticarios se convierten en “farmacéuticos” con formación académica y empiezan a dispensar medicamentos patentados producidos por industrias además de fórmulas magistrales. Se introducen leyes de salud pública para controlar la venta de sustancias peligrosas (muchos tónicos patentados contenían opio, cocaína, alcohol u otros ingredientes potentes). Por ejemplo, en 1868 el Reino Unido regula la venta de venenos y en 1875 EE.UU. prohíbe la importación de medicamentos adulterados. Estas medidas iniciales de control preludian la legislación sanitaria del siglo XX.
1906: En Estados Unidos se promulga la Ley de Alimentos y Medicamentos Puros (Pure Food & Drug Act), primera ley federal que regula medicamentos, prohibiendo la comercialización de fármacos mal etiquetados o adulterados. Se crea el antecedente de la FDA para hacer cumplir esta ley. Este paso ocurre tras escándalos de elíxires patentados peligrosos y refleja una creciente demanda social de medicamentos seguros y eficaces.
1909: El microbiólogo alemán Paul Ehrlich desarrolla el Salvarsán (compuesto 606), primer fármaco sintetizado de acción específica contra una enfermedad infecciosa. Este arsenical resultó ser un tratamiento eficaz contra la sífilis y fue apodado la “bala mágica” por dirigirse selectivamente al microbio. El Salvarsán (arsfenamina) inauguró la quimioterapia moderna y situó a la industria alemana a la vanguardia de la producción de fármacos sintéticos.
1921: Insulina – En la Universidad de Toronto, Frederick Banting y Charles Best aíslan la insulina pancreática, logrando en 1922 salvar la vida de pacientes diabéticos mediante inyecciones del extracto purificado. La introducción de la insulina, primera hormona usada terapéuticamente, convirtió a la diabetes tipo 1 de una sentencia de muerte en una enfermedad manejable. La compañía Eli Lilly industrializó su producción en 1923, ejemplificando la colaboración temprana entre descubrimientos académicos y producción farmacéutica.
1928/1940: Alexander Fleming descubre accidentalmente la penicilina en 1928 al observar la acción antibacteriana de un hongo Penicillium. Si bien Fleming publicó el hallazgo, sería a principios de los 1940 cuando Howard Florey, Ernst Chain y colegas logran purificar y producir penicilina a escala, justo a tiempo para tratar infecciones en la Segunda Guerra Mundial. La penicilina, primer antibiótico eficaz, marcó el inicio de la era de los antibióticos salvando incontables vidas. Su desarrollo a gran escala, apoyado por el gobierno y empresas (p.ej. Pfizer construyó grandes tanques de fermentación), ilustró el papel crítico de la industria farmacéutica en fabricar nuevos medicamentos descubiertos en el laboratorio.
1935: El alemán Gerhard Domagk introduce el Prontosil, primer agente antibacteriano sintético de amplio uso. Este colorante azoico demostró curar infecciones estreptocócicas en modelos animales y luego en personas, convirtiéndose en el primer antibiótico comercial (en rigor, un quimioterápico antibacteriano) disponible. El Prontosil resultó ser un profármaco que liberaba sulfanilamida en el organismo; así nacieron las sulfonamidas, precediendo a los antibióticos naturales como la penicilina. Domagk recibió el Nobel en 1939 por este avance.
Errores trágicos y regulación (años 1930): En 1937 ocurre en EE.UU. la tragedia del elixir de sulfanilamida: una formulación líquida de sulfanilamida preparada con un disolvente tóxico (dietilenglicol) causó la intoxicación y muerte de 107 personas, muchos de ellos niños. Este desastre reveló la ausencia de controles de seguridad en la comercialización de medicamentos. Como respuesta, en 1938 el Congreso de EE.UU. aprobó la Federal Food, Drug & Cosmetic Act, que por primera vez exigió pruebas previas de seguridad para cualquier nuevo fármaco antes de su venta. Fue un hito regulatorio que fortaleció el rol de la FDA en proteger al público.
Década de 1940: La posguerra ve una explosión de nuevos medicamentos. Se descubren y producen en serie antibióticos adicionales (estreptomicina en 1944 contra la tuberculosis, cloranfenicol, tetraciclinas, etc.), transformando el tratamiento de infecciones. Aparecen también los primeros fármacos quimioterápicos contra el cáncer (mostazas nitrogenadas usadas experimentalmente desde 1942) y los primeros psicofármacos (clorpromazina como antipsicótico en 1952, imipramina como antidepresivo en 1957). El sector industrial farmacéutico se consolida en estos años, con grandes compañías invirtiendo en investigación y desarrollo (I+D) de nuevos compuestos. Paralelamente, gobiernos comienzan a requerir estándares de calidad y buenas prácticas de fabricación (GMP) para asegurar la potencia y pureza de los medicamentos producidos en masa.
1957–1961: La tragedia de la talidomida sacude al mundo. Este fármaco sedante, vendido sin receta en diversos países a fines de los 50 (e indicado incluso para náuseas del embarazo), provocó miles de casos de malformaciones congénitas graves (focomelia) cuando era tomado por mujeres gestantes. Se estima que nacieron más de 10,000 bebés afectados globalmente antes de identificar la causa. El desastre llevó al retiro inmediato de la talidomida en 1961-62 y tuvo un profundo impacto regulatorio: por ejemplo, en EE.UU. la FDA (gracias a la inspectora Frances Kelsey) había bloqueado su aprobación, pero el escándalo internacional motivó en 1962 la aprobación de las Enmiendas Kefauver-Harris a la ley, que endurecieron drásticamente los requisitos para nuevos fármacos, exigiendo por primera vez pruebas de eficacia clínica además de seguridad antes de la aprobación. Asimismo, la OMS recomendó en 1962 establecer un sistema permanente de farmacovigilancia internacional para detectar a tiempo reacciones adversas de medicamentos. Desde 1968, la OMS coordina un programa global de monitoreo de efectos adversos, con centros como el Uppsala Monitoring Centre, surgido directamente como respuesta a la lección de la talidomida.
1960: Se lanza al mercado la primera píldora anticonceptiva oral (Enovid, aprobada por la FDA en 1960), tras la investigación de Gregory Pincus y John Rock con apoyo de la filántropa Katharine McCormick. La píldora, basada en hormonas sintéticas, revolucionó la planificación familiar y ejemplificó cómo un avance farmacológico puede tener enorme impacto social. Su aprobación también suscitó debates éticos y llevó a una mayor supervisión de los efectos secundarios de fármacos de uso masivo en población sana.
Años 1960-70: Proliferan nuevas clases de medicamentos: betabloqueantes para cardiología (propranolol, 1964), diuréticos tiazídicos y otros antihipertensivos, antiinflamatorios no esteroideos (indometacina, 1963), benzodiacepinas ansiolíticas (diazepam, 1963) y muchos más. La industria farmacéutica vive una época dorada de expansión global, con grandes inversiones en I+D y lanzamiento de fármacos “superventas” (blockbusters). Al mismo tiempo, se crean agencias reguladoras nacionales fuera de EE.UU.: por ejemplo, en el Reino Unido la Comisión de Seguridad de los Medicamentos se establece en 1963 tras la talidomida, y en otros países europeos surgen organismos equivalentes, que décadas más tarde convergerían en marcos comunes.
1977: La Organización Mundial de la Salud introduce el concepto de Medicamentos Esenciales y publica su primera lista modelo ese año, con unos 200 fármacos básicos. Fue una iniciativa revolucionaria de salud pública para ayudar a los países a priorizar medicamentos seguros, eficaces y coste-efectivos que cubrieran las necesidades sanitarias prioritarias. Este esfuerzo, junto con programas de vacunación masiva, contribuyó a hitos como la erradicación de la viruela en 1979. La lista de esenciales ha seguido expandiéndose (incluyendo lista pediátrica desde 2007) y constituye una guía para políticas farmacéuticas en más de 150 países.
Biotecnología (años 1970-80): Un nuevo paradigma científico irrumpe con el ADN recombinante. En 1973 Cohen y Boyer logran insertar genes en bacterias, inaugurando la ingeniería genética. En 1975 Köhler y Milstein desarrollan la técnica para producir anticuerpos monoclonales puros. Estas dos tecnologías convergen en la creación de empresas biotecnológicas (Genentech, Amgen, Biogen, etc.), inicialmente pequeñas startups colaborando con grandes farmacéuticas. El primer medicamento producido mediante ADN recombinante, la insulina humana sintética (Humulina), fue aprobada en 1982 por la FDA. Le siguieron la hormona del crecimiento recombinante (1985) y otros biofármacos. En 1986 se aprueba el primer anticuerpo monoclonal terapéutico (muromonab-CD3 para rechazo de trasplantes). Estos hitos marcan el nacimiento de la biotecnología farmacéutica, que sumó una nueva dimensión a la industria más allá de la química tradicional.
Década de 1980: La epidemia de VIH/SIDA impulsa esfuerzos globales de I+D acelerada. En 1987 se aprueba la zidovudina (AZT), primer antirretroviral, apenas unos años después de identificarse el virus, gracias a colaboraciones público-privadas y regulaciones flexibilizadas para enfermedades mortales. A finales de los 90 se logra la terapia antirretroviral combinada, convirtiendo al VIH en condición crónica manejable y mostrando la capacidad de la investigación farmacéutica para responder a crisis sanitarias.
1995: Se crea la Agencia Europea de Medicamentos (EMA) para centralizar y armonizar la evaluación de nuevos fármacos en la Unión Europea. Hasta entonces, cada país europeo aprobaba los medicamentos por separado; con la EMA (inicialmente con sede en Londres, hoy Ámsterdam), se establece un procedimiento unificado de autorización centralizada. La EMA, trabajando junto a las agencias nacionales (como la AEMPS en España), ha evaluado desde entonces miles de medicamentos para uso humano y veterinario, garantizando estándares comunes de calidad, seguridad y eficacia en toda Europa. Su creación refleja la creciente globalización de la regulación farmacéutica y la necesidad de cooperación internacional para supervisar la seguridad de los medicamentos.
2000-2003: Se completa el Proyecto Genoma Humano, abriendo la puerta a la medicina genómica. El conocimiento de los ~20,000 genes humanos acelera la identificación de dianas moleculares para fármacos y posibilita la medicina personalizada (terapias adaptadas al perfil genético del paciente). En 2001 se aprueba imatinib (Gleevec), un inhibidor dirigido a una proteína anormal específica de la leucemia mieloide crónica – este fue uno de los primeros medicamentos “de precisión” altamente efectivos, y un modelo para numerosos fármacos oncológicos dirigidos que siguieron.
Terapias biológicas avanzadas: La biotecnología alcanza nuevas cumbres con terapias celulares y génicas. En 2017 se autoriza la primera terapia CAR-T (tisagenlecleucel) para leucemia: se trata de linfocitos T del propio paciente modificados genéticamente para atacar sus células cancerosas. También en 2017 la FDA y EMA aprueban Luxturna, la primera terapia génica curativa para un tipo de ceguera hereditaria, administrando un virus con copias correctas de un gen al ojo del paciente. Estas terapias avanzadas inauguran una era en la que es posible, al menos en principio, corregir enfermedades a nivel génico o celular, aunque presentan retos de seguridad, fabricación y costo.
Inmunoterapia y nuevos tratamientos: A partir de 2010, la inmunoterapia oncológica transforma el tratamiento del cáncer: fármacos conocidos como inhibidores de puntos de control inmunitario (e.g. ipilimumab en 2011, pembrolizumab en 2014) muestran que es posible liberar las defensas inmunes del paciente contra tumores antes incurables. Paralelamente se desarrollan biológicos para enfermedades autoinmunes e inflamatorias (anticuerpos monoclonales contra TNF, interleucinas, etc.), aumentando opciones para artritis, psoriasis y otras condiciones. La industria farmacéutica del siglo XXI se caracteriza por grandes corporaciones globales que a menudo colaboran con empresas emergentes de biotecnología y con centros académicos para llevar estas innovaciones al mercado.
2020: El mundo enfrenta la pandemia de COVID-19, que acelera como nunca el desarrollo de vacunas. En menos de un año se lograron las primeras vacunas con tecnología de ARN mensajero (ARNm), jamás antes utilizadas en humanos a gran escala. En diciembre de 2020, la vacuna de ARNm de Pfizer-BioNTech contra COVID-19 obtuvo autorización de emergencia (EUA) y comenzó a aplicarse masivamente. En 2021 fue plenamente aprobada por la FDA y la EMA. El éxito de estas vacunas de ARNm (seguido por las de Moderna) demostró el potencial de esta plataforma “plug-and-play” para diseñar rápidamente vacunas efectivas. La respuesta global a la pandemia evidenció también la capacidad de la industria farmacéutica para escalar la producción a miles de millones de dosis, así como la importancia de los organismos reguladores al evaluar con rigor y prontitud la seguridad de nuevas tecnologías.
Tendencias actuales: En la actualidad, el desarrollo farmacológico explora fronteras como la terapia génica in vivo (edición genética con herramientas tipo CRISPR para tratar enfermedades hereditarias), la nanomedicina (nanopartículas para liberación dirigida de fármacos) y la aplicación de inteligencia artificial para descubrir moléculas optimizadas. La farmacogenómica comienza a usarse para adaptar tratamientos a la constitución genética individual, aumentando eficacia y reduciendo efectos adversos. Asimismo, persisten desafíos como la resistencia antimicrobiana (que exige nuevos antibióticos y políticas de uso racional) y la asequibilidad de las terapias innovadoras, que ha motivado debates éticos y políticos. Organismos internacionales como OMS, FDA, EMA y NIH siguen desempeñando un papel crucial tanto en la promoción de la investigación como en la regulación y vigilancia post-comercialización para garantizar que los medicamentos modernos sean lo más seguros y eficaces posible.
Desde las pócimas herbales de la prehistoria hasta las terapias génicas del siglo XXI, el desarrollo científico de los medicamentos ha sido un camino de progreso acumulativo. Cada época aportó avances clave: la sistematización de remedios naturales en la antigüedad, la separación de la farmacia como disciplina en la Edad Media, el advenimiento de la química y la síntesis en la modernidad, y las revoluciones biotecnológicas recientes. Asimismo, las lecciones aprendidas de errores trágicos –como el elixir de sulfanilamida y la talidomida– llevaron a fortalecer la regulación y la farmacovigilancia, creando marcos más seguros para que la innovación farmacéutica prospere sin repetir las mismas catástrofes.
Hoy, la industria farmacéutica global, en colaboración con universidades y agencias públicas, continúa explorando nuevos horizontes científicos. El objetivo común es seguir desarrollando medicamentos más específicos y efectivos, minimizando riesgos, y garantizar que los beneficios del progreso farmacológico lleguen de manera segura a toda la humanidad. La historia de los medicamentos es, en esencia, la historia de cómo el ser humano ha aprendido a vencer enfermedades a través de la ciencia, aprovechando tanto los regalos de la naturaleza como el ingenio tecnológico, mientras se adapta y mejora con cada desafío superado.
Referencias Bibliográficas: